- 科研教学
氯吡格雷药物基因组学在临床用药中的应用
根据个体基因变异与药动学、药效差异的关系设计临床个体化用药方案,以充分发挥药物对机体的作用,这样不仅可以增加首剂处方的有效性,还减少了药物的毒副作用。与某一药物个体化治疗有关的基因包括: 1.与药动学有关的酶及转运体的相关基因及表型; 2.药物作用的受体或靶点基因及其相关蛋白;3.与疾病或疾病危险因素有关的特殊的体内过程;4.由遗传多态性造成的体内生理过程的个体差异。
随着科技的不断进步,将会出现应用药物基因组学技术更加准确地选择药物和剂量的方法,依靠这些诊断手段,对每个人的基因组仅需测定一次,就可以绘制出个体化用药的蓝图。
对于临床药师而言,应用药物基因组学原理,可以解释用传统药动学、药效学无法预测的药效与不良反应的个体差异;可以借助药物基因组学的知识,合理选择初始剂量确定和维持剂量调整。现以临床应用氯吡格雷的药物基因组学理论指导个体化用药的成功案例进行介绍。
氯吡格雷( clopidogrel)是临床应用最广泛的抗血小板药物,用于心肌梗死、缺血性卒中、外周动脉性疾病和急性冠脉综合征(ACS)患者动脉粥样硬化血栓形成的预防。但氯吡格雷疗效存在很明显的个体差异,大概有5%~30%的患者对氯吡格雷治疗无反应而延误病情。其失败原因除了患者的依从性、药物未达治疗剂量、体重及其他疾病等临床因素外,遗传因素是一个很重要的原因。
氯吡格雷本身是无活性的前体药物,口服吸收后,仅15%的原形药物在肝脏经CYP2C19代谢为2-氧-氯吡格雷,再经过代谢水解生成氯吡格雷活性代谢产物,不可逆地与血小板表面二磷酸腺苷受体P2Y12结合,从而抑制血小板聚集活化;其余85%经酯酶水解为无活性代谢产物排出体外。
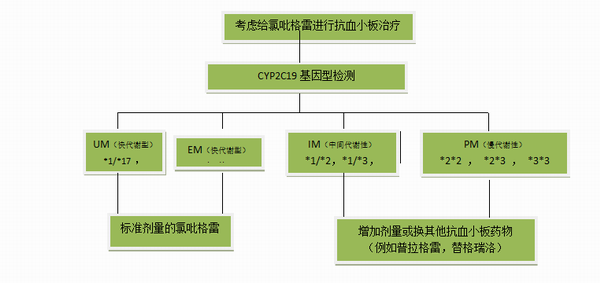
CYP2C19是氯吡格雷活化过程中的关键酶,其编码基因多态性会对氯吡格雷疗效产生重要影响。研究表明,慢代谢型的CYP2C19*2、*3和快代谢型的CYP2C19*17是导致氯吡格雷个体差异的一个重要因素。已报告的CYP2C19慢代谢基因型分布频率分别为白色人种约2%,黑色人种约4%,中国人约14%。美国一项研究发现,CYP2C19慢代谢型的活性代谢产物AUC显著低于野生型个体,并发现CYP2C19慢代谢型的心血管事件发生率比快代谢型的高约50%。
对CYP2C19慢代谢型患者,即使增加给药剂量,可能仍然难以达到相当的血小板抑制水平。因此,临床药物基因组学应用协会推荐可根据CYP2C19基因型考虑调整给药方案(图8-5)。此外,P2Y12受体作为氯吡格雷作用的靶点,其编码基因多态性也可能影响氯吡格雷抗血小板活性的个体差异。现考察最多的是P2Y12基因上4个常见SNP组成的单倍体型:野生型单倍型和突变型单倍型,研究发现,突变型单倍体携带患者在接收氯吡格雷治疗后效果较差,更易导致动脉粥样硬化的形成。
参考:《临床药物治疗学》
药剂科宣

